La capra non è una “vacca piccola”!
La Capra da Latte ad Alta Produzione (CLAP) è, tra i piccoli ruminanti, senza alcun dubbio quello che maggiormente è in grado di produrre la quantità di latte più alta per unità foraggera (UFL).

A seconda delle razze e del peso corporeo, possiede infatti un indice di conversione latte (ICL) variabile e inferiore solo alla produzione delle migliori Bovine da Latte ad Alta Produzione (BLAP). La CLAP (Capra da Latte ad Alta Produzione) differisce dalla vacca da latte per differenze di tipo:
a) Anatomico-fisiologiche
La capra infatti, in funzione al peso corporeo, ha:
- un rumine molto più piccolo ed in proporzione, un intestino molto più lungo;
- un maggior numero di papille ruminali, anche se più piccole;
- una maggiore adattabilità alle differenze climatico-ambientali;
- una maggiore velocità digestiva;
- una minore permanenza degli alimenti nei pre-stomaci e più patologie a carico degli stessi;
- una maggiore velocità di transito alimentare.
Questi fattori associati permettono alle capre di utilizzare e digerire, senza espellerle, granaglie intere come granella di mais, piselli, ceci, scarti di lenticchie, ecc.
b) Alimentari
con la possibilità di:
- utilizzare alimenti più grossolani e più poveri, con elevati tenori di lignina (ADL alta) come paglia, festuca, pascoli invecchiati, ecc.
- Possibilità di sfruttare terreni dirupati e incolti su scarpate, boscaglia cespugliosa, ecc.
- Qualità del latte.
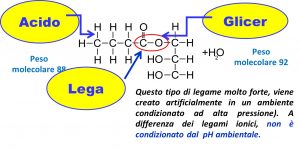
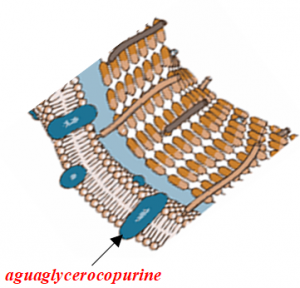
Tra il latte di capra e quello bovino esistono differenze sensibili nella composizione del grasso. Le differenze sono molto più marcate, oltre che per la naturale micronizzazione del grasso, anche per la sua stessa composizione. Infatti, il grasso di vacca omogeneizzato naturalmente misura da 6 a 7 µm mentre quello di capra da 2 a 3 µm, oltre il 50% in meno! Con questi valori è evidente la differenza significativa legata alla maggiore digeribilità del latte di capra rispetto a quello bovino tanto da essere raccomandato/consigliato nell’alimentazione di bambini, anziani ed ammalati nonché in presenza di molti tipi di intolleranza alimentare.
Marcate sono pure le differenze fra le frazioni di caseina osservabili nel tipo di coagulo del latte di capra rispetto a quello vaccino: il primo coagula in 19 minuti contro i 35 del secondo, anche se la consistenza del coagulo è inferiore in quello vaccino.
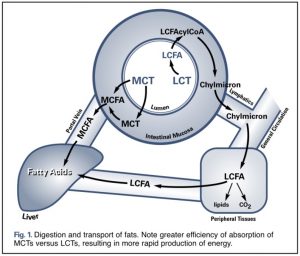
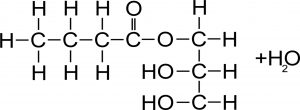
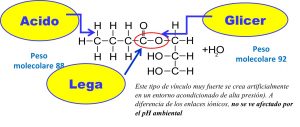
Gli acidi grassi, componenti del grasso, differiscono nella lunghezza della catena (acidi grassi a catena corta) e nella saturazione del carbonio (acidi grassi insaturi). Il grasso del latte di capra ha normalmente il 35% di acidi grassi a media-corta catena MCT (C6-C14) e tre di loro sono chiamati Caproico (C6), caprilico (C8), caprico (C10). Questi grassi MCT, oltre a trasmettere al latte il loro caratteristico e particolare sapore, hanno un’azione unica e positiva che riguarda il mondo della medicina: producono infatti benefici effetti in molte malattie metaboliche degli esseri umani (Babayan, 1981) e, qualora esterificati, vengono impiegati nella cura di patologie enteriche di suini e volatili. La capra inoltre, tenuto conto delle dovute proporzioni, rispetto ad una vacca, incide positivamente sull’impatto ambientale con emissioni 5 volte inferiori di GHG (Green House Gas o Gas Serra).

Purtroppo, nonostante tutte queste considerazioni, è innegabile che l’allevamento caprino, almeno in Italia, non abbia avuto lo sviluppo che meritava. Personalmente credo che questo fenomeno sia imputabile ad una serie di pregiudizi storico-culturali il primo dei quali è senz’altro di tipo religioso. Infatti, a partire dall’XI secolo, nell’immaginario medievale il “maligno” è stato spesso identificato nell’iconografia con rappresentazioni mostruose che richiamavano gli attributi di un caprone (coda, orecchie, barba e zampe). La marginalizzazione dell’allevamento caprino, iniziata già nel medioevo-rinascimento continuando nell’Ottocento, è proseguita fino alla prima metà del Novecento e fu solo dopo la 2° guerra mondiale che avvenne una leggera ripresa degli allevamenti, seguita da un nuovo calo imputabile all’esodo rurale e all’affermazione del consumo di latte bovino fresco. Nell’età moderna, verso la fine del secolo scorso, l’allevamento della capra ha subito un’ulteriore crisi dovuta alla concorrenza dell’allevamento dei bovini da latte, senza contare che l’aumentata richiesta di legname per l’edilizia o per l’arredamento ha generato una certa forma di ostracismo alla capra verso i pascoli boschivi, confinandola in terreni incolti ricchi di boscaglie. Dagli anni 70’ si è avuta una ripresa dell’allevamento caprino (poco in Italia e molto di più in Francia e Spagna ed ultimamente in Olanda) con la nascita di allevamenti intensivi industriali per la produzione di latte e per la sua trasformazione. A svantaggio della diffusione della capra si potrebbero inoltre annoverare le carenze conoscitive delle tecniche di allevamento, del tipo di alimentazione più adatto nonché la situazione del mercato ancora poco ricettivo verso il latte ed i prodotti tra-sformati (formaggio, yogurt, latte aromatizzato per bambini o per neonati, ecc).
Per ciò che concerne l’allevamento della bovina da latte, è mia convinzione che la sua popolazione sia destinata ad una certa stasi nella crescita se non addirittura ad una recessione. In futuro è probabile che si potrà assistere al fenomeno di selezione e concentrazione delle mandrie con la scelta più o meno obbligata di destinare la produzione di latte prevalentemente o limitatamente alla sua trasformazione in formaggi o prodotti “tipici” locali. Una scelta che potrebbe condizionare negativamente i giovani potenziali allevatori nella scelta di questa attività. Infine non va sottovalutato che i cambiamenti climatici in essere potranno ridurre significativamente la disponibilità di foraggi di cui necessitano le bovine da latte, senza contare l’obbiettivo universalmente dichiarato di ridurre le emissioni di Gas Serra.

Allevamento “Il Carro” Putignano (BA)
Potrà apparire anacronistico al giorno d’oggi, ma secondo il mio parere, il latte di capra potrebbe essere l’unico ad essere prodotto in futuro senza alcuna limitazione. Un indicatore per comprendere il probabile evolversi della situazione, è quello riferito ai dati relativi all’importazione di latte di capra biologico in polvere, una nuova tendenza del mercato Cinese. Rispetto alle tradizionali formule di latte in polvere, il latte di capra e il latte biologico che richiedono standard elevati in termini di provenienza, ingredienti e produzione, hanno registrato una rapida crescita negli ultimi due anni. Già a partire dal 2022, le piattaforme cinesi di vendita online hanno registrato un aumento significativo dell’attività anche con il latte di capra il cui consumo è in crescita. Inoltre anche a causa degli scandali che hanno coinvolto i loro marchi, i consumatori cinesi ritengono più affidabili i marchi stranieri. E’ auspicabile che anche questi segnali possano contribuire ad incoraggiare nuovi imprenditori verso l’allevamento di qualità della capra.
Si ringrazia Alessandra Melis, dell’Azienda agricola Salvatore Melis di Villasalto (SU), per la gentile concessione della foto di copertina.
Di Giulio Gabaldo|5 Dicembre 2024